Veja quais são os elementos químicos e como identificá-los
Compreender como escrever cada elemento químico e suas propriedades é essencial para bons resultados no vestibular
 Imagem: Prostock-studio | ShutterStock
Imagem: Prostock-studio | ShutterStock
Elemento químico é o conjunto de todos os átomos com o mesmo número atômico (Z), representado por um símbolo que, em geral, deve ser a letra inicial do seu nome sozinha ou aglutinada, caso já exista. Outros derivam do latim, como o Sódio (natrium): Na.
A notação simples é feita colocando o símbolo do elemento no centro, o número atômico (Z) à esquerda e abaixo do símbolo, e o número de massa (A) à esquerda ou direita acima do símbolo:
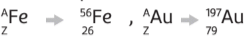
Tabela periódica
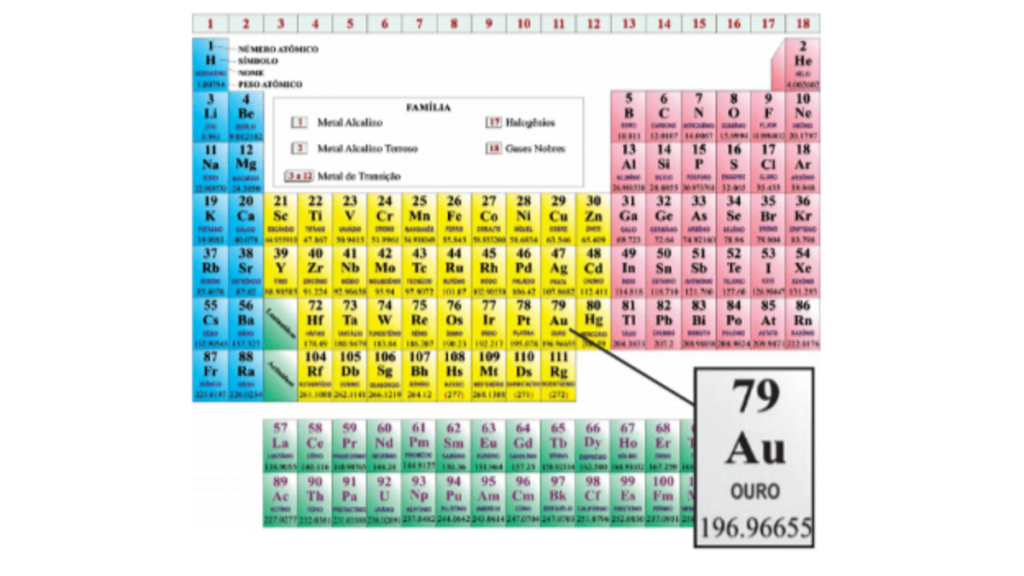
Cada quadro da tabela fornece os dados referentes ao elemento químico: símbolo, massa atômica, número atômico, nome do elemento, elétrons nas camadas e se o elemento é radioativo. As filas horizontais são os períodos. Neles, os elementos químicos estão dispostos na ordem crescente de seus números atômicos.
O número da ordem do período indica o número de níveis energéticos ou camadas eletrônicas do elemento. As colunas verticais constituem as famílias ou os grupos, nos quais os elementos estão reunidos segundo suas propriedades químicas: alcalinos, alcalinos terrosos, família do boro, família do Carbono, família do nitrogênio, família dos calcogênios, família dos halogênios e gases nobres.
Grupos dos elementos químicos
Os elementos químicos podem ser resumidos em três grupos: metais, não metais e gases nobres. O Hidrogênio (H) não se encaixa em nenhuma dessas classificações porque possui características próprias. Normalmente, os setores são representados pela diferenciação nas cores, mas existem muitas tabelas com ênfases diferentes.
Metais: são elementos químicos sólidos à temperatura de 25ºC e pressão de 1atm (menos o Hg, Mercúrio) com propriedades específicas como brilho, condutividade térmica e elétrica, maleabilidade e ductibilidade (podem ser reduzidos a fios). Ligas metálicas são misturas de dois ou mais metais para atingir determinadas aplicações, como o bronze (Cobre e Estanho) e o latão (Cobre e Zinco). Exemplos: Ouro (Au), Prata (Ag) e Cobre (Cu).
Não metais: são maus condutores de eletricidade, quase não apresentam brilho, não são maleáveis nem dúcteis. Tendem a formar ânions (íons negativos). Exemplos: Carbono (C), Flúor (F) e Cloro (Cl).
Gases nobres: constituem cerca de 1% do ar. É muito difícil conseguir compostos com esses gases. Raramente eles reagem, porque são muito estáveis. Suas camadas exteriores estão completamente preenchidas de elétrons, e todos ficam no grupo 18 da tabela periódica. Exemplos: Hélio (He), Argônio (Ar) e Radônio (Rn).
Carbono: é o elemento que tem sua massa padronizada (A =12). Uma unidade de massa atômica (u) é 1/12 da massa de um átomo de Carbono (A=12). Isso equivale a estabelecer o valor 12u como a massa de um átomo de Carbono. Quando medimos uma grandeza, comparamos com outra como referência. Para a Química, a comparação é sempre em relação à massa do Carbono. Quando se afirma que a massa de um elemento X é igual a 24u, significa que a sua massa é 24 vezes maior que a massa de 12u do átomo do Carbono. Ou seja, o dobro.
Por Tao Consult

Comentários
Conteúdo para assinantes. Assine JP Premium.