Novo microscópio 3D filma células em movimento com definição sem precedentes
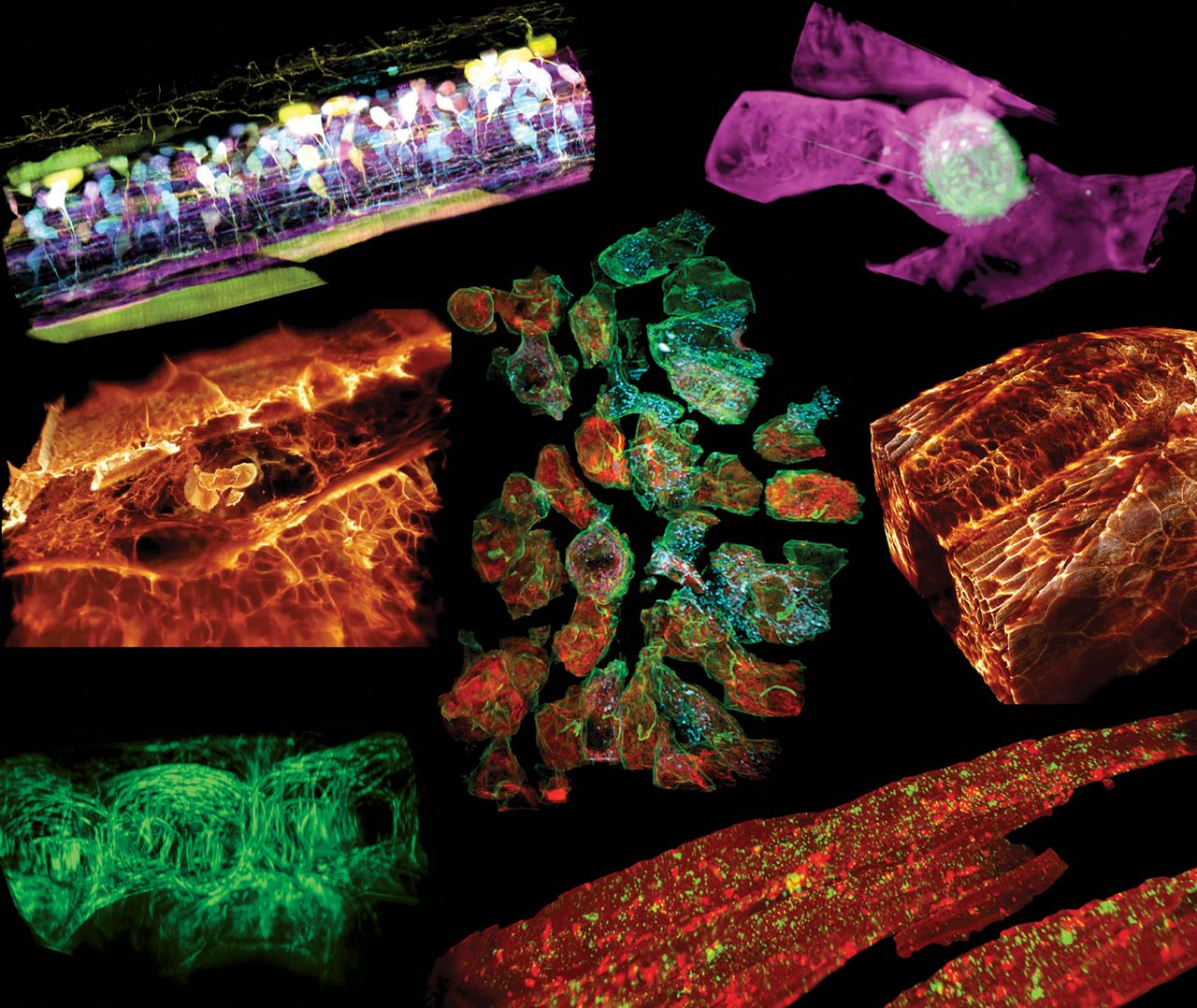
Combinando duas tecnologias de microscopia, um grupo internacional de cientistas mostrou como fazer imagens 3D detalhadas de sistemas vivos em movimento, como células de câncer se espalhando, circuitos nervo-espinhais se conectando e células imunológicas atravessando órgãos.
Até agora, ao observar as células individualmente, os microscópios eram lentos demais para seguir suas ações em 3D, de acordo com o novo estudo publicado nesta quinta-feira (19) na revista Science.
O grupo de pesquisadores foi coordenado pelo físico americano Eric Betzig, do Instituto Médico Howard Hughes (Estados Unidos), que ganhou o Prêmio Nobel da Química em 2014 por suas inovações em microscopia. Na nova pesquisa, duas das técnicas que renderam o Nobel a Betzig foram combinadas: a microscopia de lâmina de luz treliçada e a óptica adaptativa.
Segundo o estudo, na microscopia de lâmina de luz treliçada, uma “lâmina” luminosa varre repetidamente o interior da célula para adquirir imagens em duas dimensões e, a partir delas, um software constrói um vídeo 3D de alta resolução. Já a óptica adaptativa é um método semelhante ao que utilizado em astronomia para ‘desembaralhar’ e tornar mais definidas as imagens vistas através da turbulência da atmosfera.
No artigo na Science, os cientistas testaram a combinação de técnicas observando os movimentos de células do sistema imune cruzando o ouvido interno de um peixe da espécie Danio rerio, conhecido no Brasil como “paulistinha”.
De acordo com Betzig, há centenas de anos os cientistas têm obtido imagens de células vivas por meio de microscópios, mas só conseguiam boa definição em células isoladas em lâminas de vidro
Segundo o cientista, isso é um problema, porque os grandes grupos de células dentro de organismos completos misturam a luz do microscópio. “Isso levanta a incômoda dúvida de se estamos mesmo vendo células em seu estado nativo, alegremente abrigadas no organismo em que elas evoluíram”, afirmou Betzig.
Mesmo quando as células são observadas individualmente, os microscópios mais utilizados para estudar o funcionamento interno delas são lentos demais para seguir a ação em 3D. Esses microscópios banham as células com uma luz que é de milhares a milhões de vezes mais brilhante que a do Sol intenso do deserto, segundo Betzig.
“Isso também contribui para nosso temor de que não estejamos vendo as células em sua forma natural. Frequentemente ouvimos que ‘ver é acreditar’, mas quando se trata de biologia celular, acho que a questão mais apropriada é: será que podemos acreditar no que vemos?”, disse o cientista.
Utilizando a combinação das duas técnicas inovadoras, os cientistas conseguiram observar a “coreografia” interna das células rapidamente e em três dimensões. Com um laser, ele criam um ponto brilhante de luz na região da amostra que querem observar. Com isso, a natureza das distorções da imagem são determinadas com precisão e os pesquisadores podem corrigí-las.
É o mesmo princípio utilizado na óptica adaptativa da astronomia, na qual um laser é apontado para o céu, na região próxima ao astro a ser observado, a fim de determinar previamente o tipo de aberração visual. Isso permite que as distorções sejam corrigidas com a aplicação de distorções opostas. No caso do novo microscópio, a “distorção corretiva” é aplicada com um modulador de luz e um espelho deformável.
O resultado é a abertura de uma janela inédita para a observação do funcionamento dos sistemas biológicos, revelando uma paisagem subcelular que lembra o movimento de uma grande metrópole.
Em um dos vídeos feitos com o microscópio, uma célula imunológica laranja se contorce freneticamente pelo ouvido de um peixe paulistinha, enquanto apanha partículas azuis de açúcar em seu trajeto. Em outro vídeo, uma célula de câncer puxa apêndices pegajosos enquanto rola através de um vaso sanguíneo em cujas paredes tenta ganhar força.
Apesar da extrema complexidade do ambiente multicelular 3-D, segundo Betzig, a clareza das imagens produzidas por sua equipe permite que eles “explodam” no computador as células individuais em um tecido para focar na dinâmica de uma delas em particular, para observar, por exemplo, a remodelação de organelas internas durante a divisão celular.
Segundo Betzig, seria difícil observar tantos detalhes sem a óptica adaptativa. “É confuso demais”, disse. Em sua opinião, a óptica adaptativa é uma das áreas mais importantes na pesquisa de microscopia atualmente, e o microscópio de lâminas de luz treliçada, que se destaca em imagens ao vivo 3D, é a plataforma perfeita para mostrar sua potência.
“A óptica adaptativa ainda não decolou, porque a tecnologia tem sido complicada, cara e, até agora, o esforço não valia a pena. Mas dentro de 10 anos ela já será usada por biólogos de todos os lugares”, disse.
O próximo grande passo nessa linha de pesquisas é tornar essa tecnologia acessível e intuitiva. “Demonstrações técnicas e publicações não chegam a ser úteis. A única métrica pela qual um microscópio deve ser julgado é o número de pessoas que o utilizam e o significado do que descobrem com ele”, disse Betzig, que ainda este ano mudará do Instituto Howard Hughes para a Universidade de Califórnia, em Berkeley.
O novo microscópio ocupa uma mesa de mais de três metros de comprimento. “Por enquanto ainda é um monstro do Frankenstein, mas já estamos trabalhando em uma nova versão que deverá caber em uma pequena mesa, com um custo acessível para os laboratórios”, afirmou.
Participaram da pesquisa cientistas do Hospital da Criança de Boston, da Universidade de Harvard, da Universidade Brook, da Universidade da Califórnia em Berkeley, – todas nos Estados Unidos -, da Universidade de Exeter (Reino Unido) e do Instituto de Tecnologia de Karlshue (Alemanha).

Comentários
Conteúdo para assinantes. Assine JP Premium.