Anvisa interrompe estudos clínicos da Coronavac após ‘evento adverso grave’
Em nota, o Instituto Butantan disse ter sido ‘surpreendido’ pela decisão e que está apurando a situação
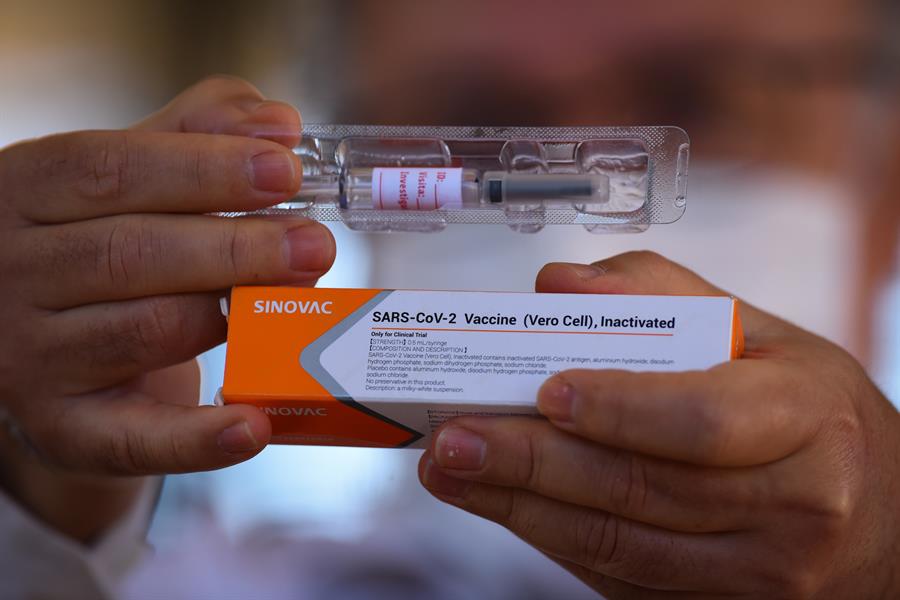
A Agência Nacional de Vigilância Sanitária (Anvisa) informou na noite desta segunda-feira, 9, que interrompeu os estudos clínicos da vacina Coronavac, produzida pela farmacêutica chinesa Sinovac em parceria com o Instituto Butantan, em São Paulo. Em nota, a Anvisa disse que a decisão foi tomada após a ocorrência de um evento adverso grave que teria acontecido no dia 29 de outubro. A agência também informou que vai avaliar os dados e julgar a continuidade ou não do estudo.
O anúncio da interrupção foi feito no mesmo dia em que o governador do Estado de São Paulo, João Doria (PSDB) anunciou que as primeiras doses do imunizantes chegariam no estado no dia 20 de novembro. Doria também exaltou que a Coronavac era “a vacina mais promissora e mais segura dentre as vacinas contra a COVID-19”. Em nota, o Instituto Butantan, que produz a vacina em parceria com a Sinovac, disse ter sido “surpreendido” pela decisão e que está “apurando em detalhes o que houve com o andamento dos estudos” da Coronavac.
Confira na íntegra a nota da Anvisa:
Após ocorrência de Evento Adverso Grave* a Anvisa determinou a interrupção do estudo clínico da vacina Coronavac. O evento ocorrido no dia 29/10 foi comunicado à Anvisa, que decidiu interromper o estudo para avaliar os dados observados até o momento e julgar sobre o risco/benefício da continuidade do estudo. Esse tipo de interrupção é previsto pelas normativas da Anvisa e faz parte dos procedimentos de Boas Práticas Clínicas, esperado para estudos clínicos conduzidos no Brasil.
Com a interrupção do estudo, nenhum novo voluntário poderá ser vacinado. A Anvisa reitera que, segundo regulamentos nacionais e internacionais de Boas Práticas Clínicas, os dados sobre voluntários de pesquisas clínicas devem ser mantidos em sigilo, em conformidade com princípios de confidencialidade, dignidade humana e proteção dos participantes. A Anvisa mantém o compromisso com o Estado brasileiro de atuar em prol dos interesses da saúde pública.
*De acordo com a RDC 09/2015 são considerados eventos adversos graves:
- óbito;
- evento adverso potencialmente fatal (aquele que, na opinião do notificante, coloca o indivíduo sob risco imediato de morte devido ao evento adverso ocorrido);
- incapacidade/invalidez persistente ou significativa;
- exige internação hospitalar do paciente ou prolonga internação;
- anomalia congênita ou defeito de nascimento;
- qualquer suspeita de transmissão de agente infeccioso por meio de um dispositivo médico;
- evento clinicamente significante



Comentários
Conteúdo para assinantes. Assine JP Premium.