Anvisa recebe pedido de uso emergencial de vacina contra a Covid-19 da Sinopharm
Solicitação foi apresentada pela Blau Farmacêutica, que representa o laboratório chinês no Brasil; imunizante é aplicado em duas doses, com um intervalo de três a quatro semanas entre elas
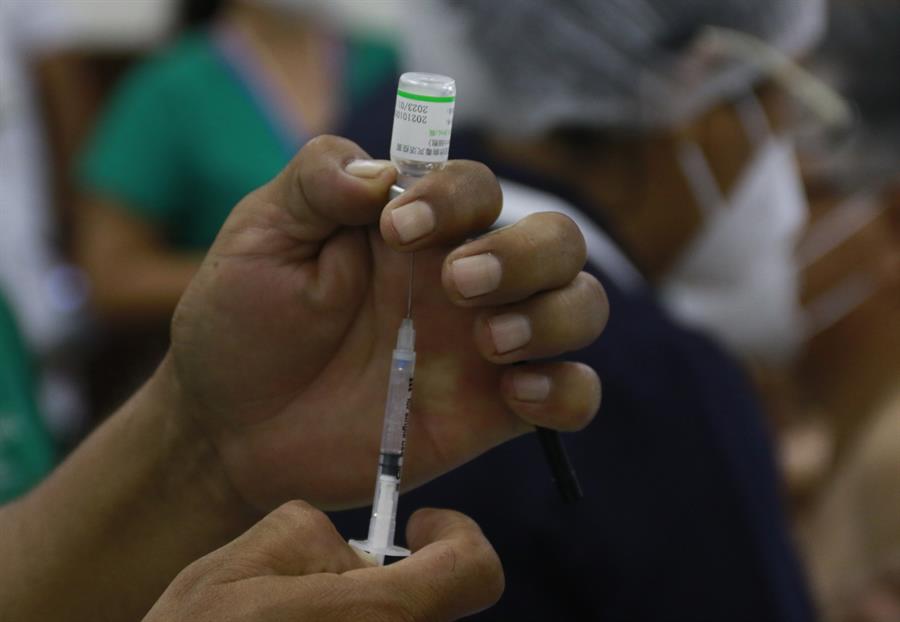
A Agência Nacional de Vigilância Sanitária (Anvisa) recebeu nesta segunda-feira, 26, o pedido de uso emergencial da vacina contra a Covid-19 da Sinopharm. A solicitação foi apresentada pela Blau Farmacêutica, que representa a vacina do laboratório chinês no Brasil. Assim como os imunizantes da Pfizer–BioNTech, Johnson & Johnson, AstraZeneca–Universidade de Oxford, Moderna e Sinovac, a vacina da Sinopharm também passou pela revisão de dados científicos e avaliação dos critérios de eficácia e segurança exigidos pela Organização Mundial da Saúde (OMS) e teve seu uso emergencial aprovado pela entidade internacional. Assim como a CoronaVac, o imunizante é produzido a partir de um vírus inativado. A vacina é aplicada em duas doses, com um intervalo de três a quatro semanas entre elas. É recomendada para pessoas acima de 18 anos, de acordo com os dados conhecidos até o momento.
As pesquisas da Sinopharm foram desenvolvidas em países como Argentina, Peru, Emirados Árabes, Egito e China. A Anvisa ressalta que a falta de testes no país não impede a submissão do pedido de autorização para uso emergencial ou registro. As primeiras 24 horas serão utilizadas para fazer uma triagem do processo e verificar se os documentos necessários para avaliação estão disponíveis. Se houver informações importantes faltando, a Anvisa pode solicitar dados adicionais ao laboratório. O prazo de análise da solicitação de uso emergencial pela agência varia de sete a 30 dias. “Pela norma, o prazo de avaliação será de sete dias quando houver desenvolvimento clínico da vacina no Brasil ou quando o relatório ou parecer técnico emitido pela autoridade sanitária estrangeira seja capaz de comprovar que a vacina atende aos padrões de qualidade, de eficácia e de segurança estabelecidos pela OMS ou pelo ICH (Conselho Internacional para Harmonização de Requisitos Técnicos para Medicamentos de Uso Humano) e pelo PIC/S (Esquema de Cooperação em Inspeção Farmacêutica)”, detalha a agência, que acrescenta que o prazo de avaliação do pedido de uso emergencial não considera o tempo do processo em status de exigência técnica.




Comentários
Conteúdo para assinantes. Assine JP Premium.