Anvisa simplifica processo para aprovar uso emergencial de vacinas contra a Covid-19
Com novo protocolo, anunciado durante coletiva de imprensa nesta quarta-feira, 3, realização de testes clínicos da fase 3 em voluntários brasileiros deixa de ser obrigatória
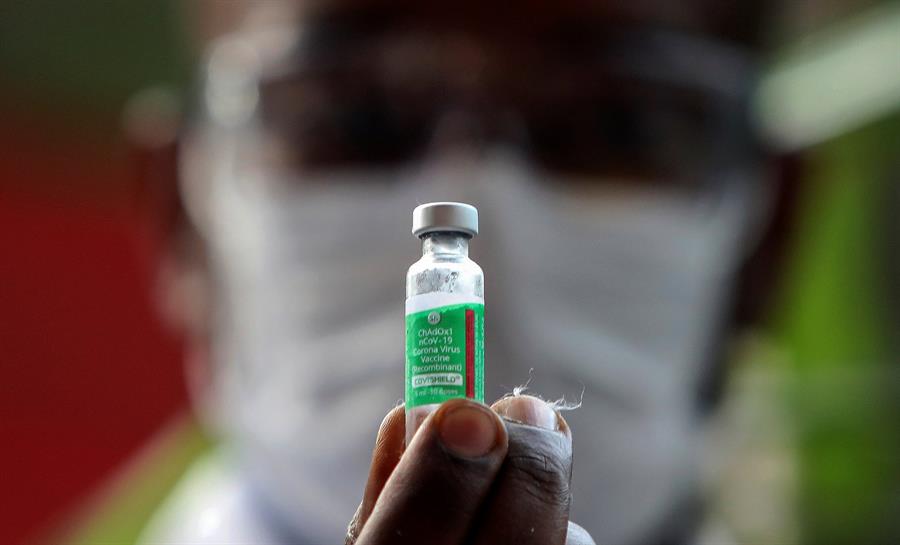
Após uma nova determinação da Agência Nacional de Vigilância Sanitária (Anvisa), a realização dos estudos clínicos da fase 3 do desenvolvimento de vacinas contra a Covid-19 em brasileiros deixou de ser obrigatória. O novo protocolo foi anunciado pela agência nesta quarta-feira, 3, em coletiva de imprensa e visa simplificar o processo de aprovação do uso emergencial de vacinas no Brasil. Além da mudança em relação aos testes, a Anvisa agora terá um prazo de até 30 dias para analisar os pedidos feitos de acordo com as novas regras. As mudanças devem permitir que outras vacinas passem a ser utilizadas no Brasil. Atualmente, a CoronaVac, desenvolvida pelo Instituto Butantan e pelo laboratório chinês Sinovac, e a vacina da Universidade de Oxford em parceria com a AstraZeneca estão aprovadas e sendo utilizadas na população brasileira.
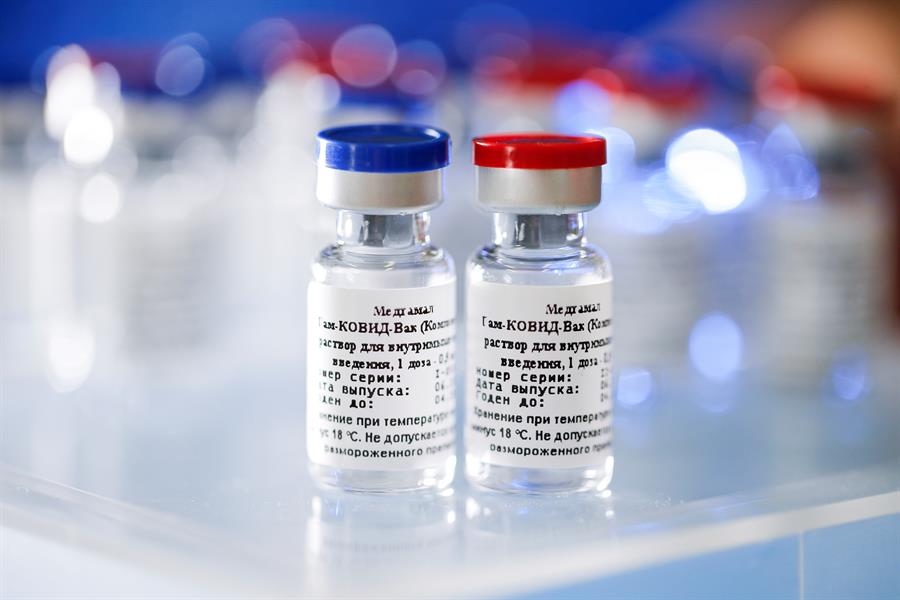
Durante coletiva, o gerente de medicamentos da Anvisa, Gustavo Mendes, explicou que, na ausência dos testes, outros critérios deverão ser atendidos. São eles o acompanhamento dos participantes para avaliação de eficácia, a garantia de acesso aos dados e demonstração de estudos pré-clínicos conduzidos de acordo com diretrizes nacionais e internacionais. Caso os estudos de fase 3 tenham sido concluídos fora do Brasil, as empresas que desejam registrar suas vacinas deverão se comprometer o desenvolvimento dos imunizantes em todos os aspectos, garantindo a segurança do imunizante, e solicitar o registro sanitário no país. A Sputnik V tem eficácia de 91,6% contra casos sintomáticos da Covid-19. Os dados foram publicados na terça na revista científica The Lancet. A vacina já está sendo aplicada na Rússia e em outros países, como Argentina. Com o fim dessa exigência, o processo para a entrada de outras vacinas no país será facilitado. O laboratório Bharat Biotech, responsável pela produção da vacina indiana, já demonstrou interesse em trazer a Covaxin ao Brasil. Após o anúncio da agência, o Ministério da Saúde informou que já negocia a compra de 30 milhões de doses das vacinas. Deste total, Deste total, 10 milhões de doses são da vacina russa e os outros 20 milhões da vacina indiana. De acordo com a pasta, a expectativa é receber os imunizantes entre fevereiro e março.


Comentários
Conteúdo para assinantes. Assine JP Premium.