Butantan muda estratégia e vai pedir registro da CoronaVac na Anvisa dia 23 de dezembro
Doria alegou que mudança se deu para obter dados finais sobre o imunizante e, assim, solicitar seu uso definitivo, e não emergencial; se aprovada na China, agência brasileira terá até 72h para analisar fármaco
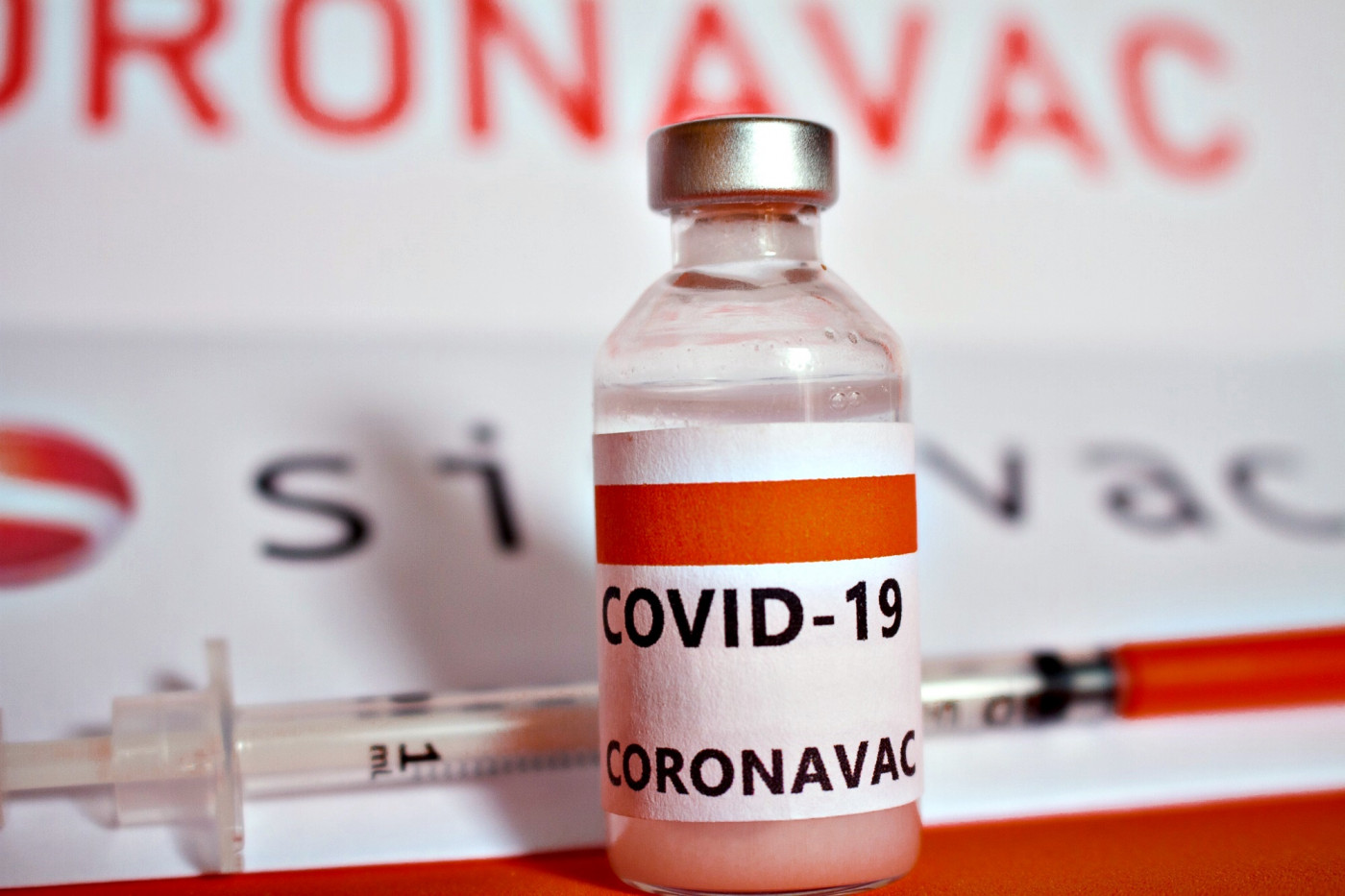
O governo do Estado de São Paulo anunciou, nesta segunda-feira, 14, que o Instituto Butantan decidiu acatar a recomendação do comitê internacional independente e mudar a estratégia para um registro mais rápido da CoronaVac na Anvisa. De acordo com o governador João Doria, isso aconteceu porque os estudos clínicos atingiram o número mínimo de infectados para registro — 154 voluntários. Então, os estudos clínicos no país serão encerrados. No Brasil, foram 11 mil voluntários em 16 centros de pesquisa espalhados por sete estados e o Distrito Federal. Neste segunda, já são 170 brasileiros que participam dos estudos da vacina em parceria com o laboratório Sinovac que contraíram a Covid-19 e tomaram ou a vacina ou um placebo.
Segundo ele, o Instituto Butantan vai solicitar o registro definitivo da CoronaVac na Anvisa no dia 23 de dezembro para vacina — não mais para uso emergencial. As expectativas são de que a chancela aconteça até o fim de 2020, de forma que o Plano Estadual de Imunização (PEI) apresentado na última semana pelo governador de São Paulo seja cumprido e a vacinação iniciada no dia 25 de janeiro com autorização da Anvisa ou de órgão internacional similar. “Na prática, optar por isso garante agilidade no pedido de reconhecimento”, disse Doria. De acordo com ele, registrar os estudos conclusivos permite maior confiabilidade na análise de eficácia da vacina. A taxa mínima recomendada é de 50% como parâmetro de proteção.
Esse registro vai acontecer do forma simultânea na agência brasileira e no órgão equivalente da China, o NMPA (National Medical Products Administration). Na prática, a medida pressiona a Anvisa, uma vez que a lei 14.006, aprovada em fevereiro deste ano, obriga a agência reguladora a analisar, em um período de até 72 horas, qualquer fármaco contra o coronavírus que tenha a aprovação de quatro agências de vigilância – além do NMPA, as outras três são a FDA (Food and Drug Administration), dos Estados Unidos, a EMA (European Medicines Agency), da Europa; e a PMDA (Pharmaceuticals and Medical Devices Agency), do Japão. Segundo o diretor do Instituto Butantan, Dimas Covas, as expectativas são de meio bilhão de doses da CoronaVac no 1º semestre de 2021 para o Brasil, outros países da América Latina e do mundo. O Estado de São Paulo tem, nesta segunda, 1.337.016 casos confirmados da Covid-19 e 44.050 óbitos pela doença. A taxa de ocupação dos leitos de UTI no Estado está em 59,8% e em 65,5% na Grande São Paulo. Quanto ao número de internados, 4.634 estão em UTI e 6.001 em enfermaria — entre casos confirmados e suspeitos. Em relação à semana epidemiológica anterior, São Paulo teve uma alta de 4% nos casos, de 5% nas internações e de 9% nos óbitos pela doença.


Comentários
Conteúdo para assinantes. Assine JP Premium.