‘Lei Covid’ e aval internacional podem acelerar liberação da CoronaVac
A legislação determina prazo de 72h para análise da Anvisa; sem manifestação do órgão, a autorização é concedida automaticamente
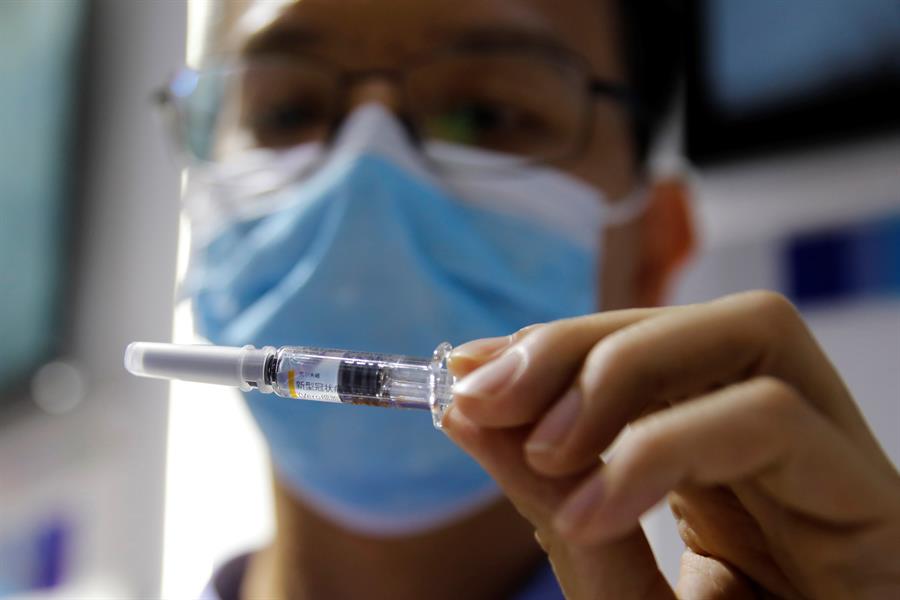
São Paulo se prepara para a primeira fase de vacinação contra a Covid-19 em 25 de janeiro. Porém, o governo acertou que enviaria dados da fase 3 de testes para a Agência Nacional de Vigilância Sanitária (Anvisa) em 15 de dezembro, ou seja, o órgão teria 40 dias para analisar a eficácia e a segurança da Coronavac, desenvolvida pelo Instituto Butantan em parceria com a chinesa Sinovac. Sem uma rápida aprovação, o Estado pode apelar para órgãos sanitários de outros países, conforme avalia o advogado especializado em direito internacional José Luiz Souza Moraes. “A lei apelidada da Covid é do começo desse ano, logo do começo da pandemia, que já permite a utilização de vacinas que sejam aprovadas no mínimo por órgão internacionais de vigilância sanitária, como a FDA norte-americana, como a EMA europeia, ou orgãos equivalentes do Japão e da China. Sem dúvida, o poder Judiciário pode ser acionado e permitir que sejam realizadas vacinações com base nesse critério já previsto em lei.”
A legislação brasileira permite o uso da “Lei Covid“. Trata-se de uma concessão de uso da vacina caso ela tenha registro em países como Estados Unidos, Japão, China ou na Europa. No caso da utilização dessa lei, a Anvisa tem até 72 horas para autorizar a distribuição do imunizante. Se o órgão não se manifestar, a autorização é concedida automaticamente, como reforça o presidente da Ordem dos Advogados do Brasil Felipe Santa Cruz. “A Constituição Federal determina que é dever do estado garantir a saúde e a vida da população brasileira. O governo está autorizado por legislação recente a liberar pedidos depatentes de vacinas produzidas no mundo todo na Anvisa tem 72 horas”, explica. É bom lembrar que o aval para uso emergencial só permite a aplicação da vacina na rede pública. A Anvisa já concluiu a inspeção na fábrica da Sinovac, na China, e os resultados, vitais para a eventual autorização, devem ser divulgados entre os dias 30 de dezembro e 11 de janeiro.
*Com informações da repórter Mônica Simões

Comentários
Conteúdo para assinantes. Assine JP Premium.