Farmacêutica pede autorização da Anvisa para testes clínicos da vacina Sputnik V
Empresa diz estar seguindo as normas da Anvisa, especialmente as relativos à “segurança, eficácia e bem-estar da população brasileira!
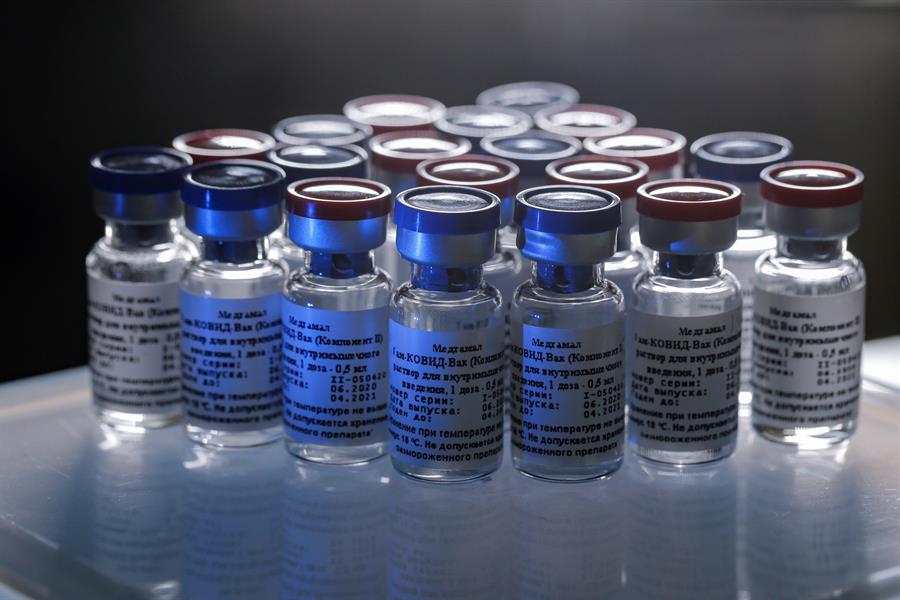
A União Química, em parceria com o Fundo de Investimentos Diretos da Rússia (RDIF) entrou com um pedido de autorização da Agência Nacional de Vigilância Sanitária (Anvisa) para iniciar a fase 3 de testes clínicos da vacina Sputnik V no Brasil. A empresa é responsável pela produção do imunizante contra a Covid-19 na América Latina. O pedido foi feito nesta terça-feira, 29. Em nota, a União Química disse que tem adotado medidas necessárias para cumprir os requisitos e exigências da Anvisa, especialmente os relativos à “segurança, eficácia e bem-estar da população brasileira”. A empresa também disse que a expectativa de produção do imunizante, “por intermédio de transferência de tecnologia” irá começar em janeiro de 2021.
Em nota, a Anvisa disse que “o pedido se refere à realização de pesquisa clínica, que é a pesquisa com seres humanos” e que “a autorização da Anvisa é obrigatória para pesquisas que tenham como foco o futuro registro de uma vacina ou medicamento”. A agência também confirmou que foram realizadas reuniões para ajustar a formatação do pedido. A Sputnik V foi a primeira vacina a ser registrada no mundo, tendo sido desenvolvida em uma plataforma com base de adenovírus humanos. Em nota, a empresa também afirmou que “todos os esforços industriais, tecnológicos e científicos estão sendo realizados de forma a disponibilizar o quanto antes o maior número de doses possíveis para o plano nacional de operacionalização da vacinação contra COVID-19 do Ministério da Saúde”.




Comentários
Conteúdo para assinantes. Assine JP Premium.