Pfizer e BioNtech solicitam uso emergencial da vacina contra Covid-19
As empresas farmacêuticas afirmam que, se o pedido for aprovado, o imunizante para a doença causada pelo coronavírus pode estar disponível nos Estados Unidos até o fim de dezembro
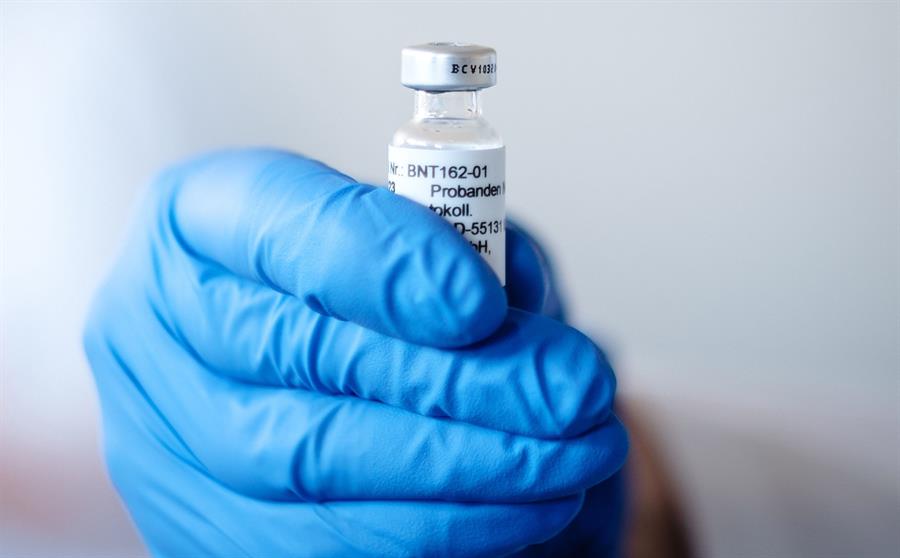
Nesta sexta-feira, 20, as empresas farmacêuticas Pfizer e a BioNtech solicitaram uma autorização de uso emergencial da vacina contra a Covid-19 que está sendo desenvolvida por elas conjuntamente. O pedido foi feito à Agência de Medicamentos e Alimentos dos Estados Unidos (FDA, na sigla em inglês). Esse é o primeiro imunizante a buscar essa permissão da agência reguladora norte-americana. Em comunicado, a Pfizer afirmou que, se o pedido for aprovado, a sua vacina pode estar disponível até o fim de dezembro para os grupos de risco, incluindo trabalhadores da área de saúde, idosos e pessoas com problemas graves de saúde. “O lançamento nos Estados Unidos representa um marco importante em nossa jornada para entregar uma vacina contra o coronavírus ao mundo, e agora temos um retrato mais completo do perfil de eficácia e segurança de nossa vacina, dando-nos confiança em seu potencial”, disse o presidente e CEO da Pfizer, Albert Bourla.
O processo de monitoramento da FDA deve levar algumas semanas. O comitê consultivo já marcou uma reunião no início de dezembro para rever a vacina, que já demonstrou possuir eficácia de 95% contra a doença 28 dias após a primeira dose. Os únicos efeitos colaterais significativos foram fadiga (3,8%) e dor de cabeça (2%). No total, quase 43.000 pessoas participaram desse teste em todo o mundo, das quais pouco mais de 41.000 receberam uma segunda dose no último dia 13. Em 22 de julho, a Pfizer anunciou que o governo dos Estados Unidos compraria 100 milhões de doses da vacina por um total de US$ 1,95 bilhão e teria a possibilidade de adquirir mais 500 milhões de doses.
*Com informações da EFE


Comentários
Conteúdo para assinantes. Assine JP Premium.