CoronaVac é segura? Veja o que se sabe sobre a vacina chinesa até agora
Potencial vacina do Instituto Butantan e da Sinovac é testada em 13 mil voluntários no Brasil e 120 mil doses chegaram ao Brasil nesta quinta-feira, 19

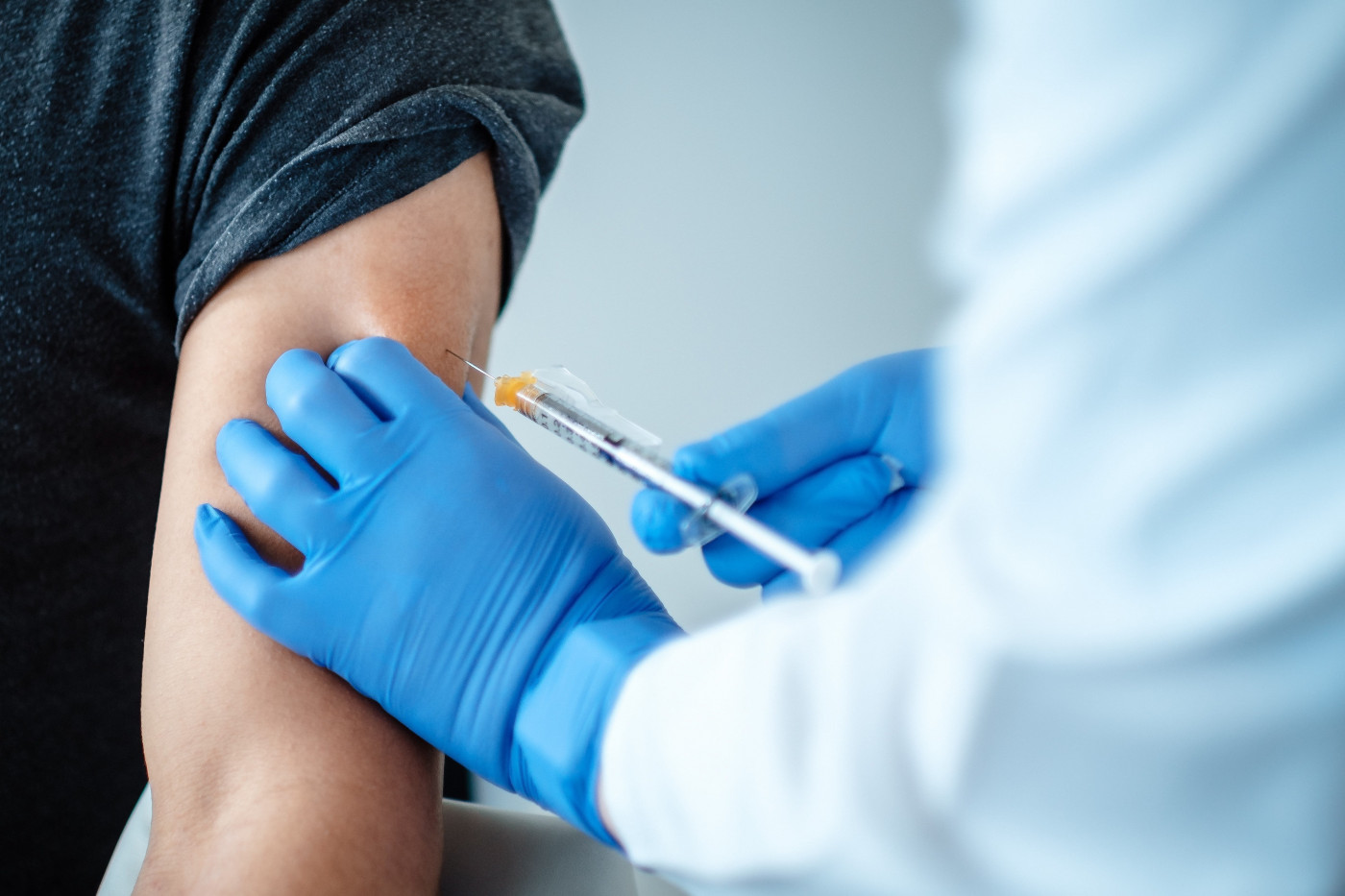
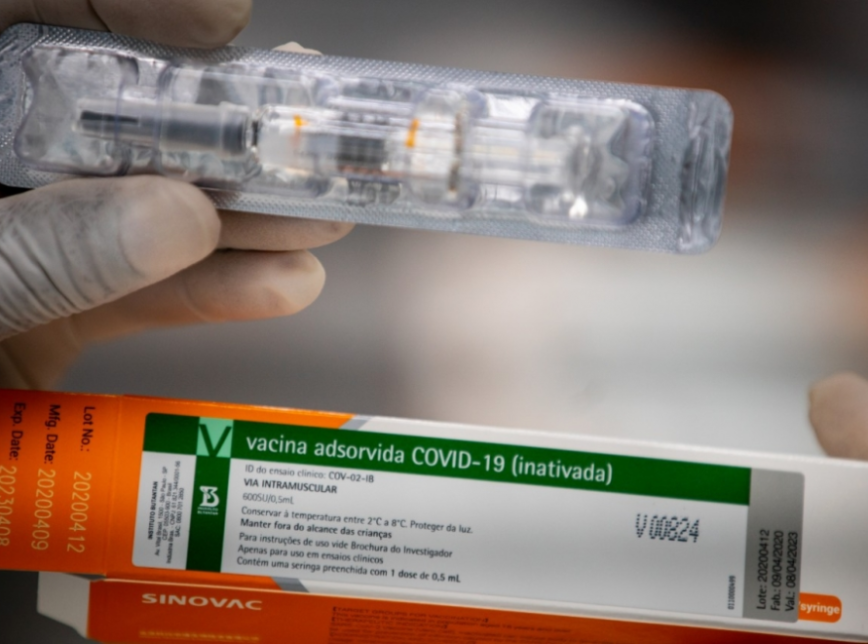
A CoronaVac é a potencial vacina contra a Covid-19 que está sendo produzida pelo Instituto Butantan, em São Paulo, junto com o laboratório chinês Sinovac. Anunciada pelo governador do Estado, João Doria, no dia 11 de junho, ela chegou ao Brasil já na fase 3 dos testes clínicos. O contrato prevê, inicialmente, 60 milhões de doses do imunizante e a transferência de tecnologia da vacina. A princípio, ela seria testada em 9 mil voluntários, necessariamente médicos ou profissionais da área da saúde, em 12 centros de pesquisa em São Paulo, no Rio de Janeiro, em Brasília, em Minas Gerais, no Paraná e no Rio Grande do Sul.
Com o passar dos meses, esses números aumentaram para 13 mil voluntários e 22 centros de pesquisa — adicionando Mato Grosso e Mato Grosso do Sul na lista. As primeiras doses para testagem chegaram ao Brasil em 20 de julho, pouco mais de um mês após o anúncio. Os testes, de fato, foram iniciados no dia 21 de julho no Hospital das Clínicas da Faculdade de Medicina da Universidade de São Paulo. A primeira pessoa a receber a dose da CoronaVac no país foi a médica Stefania Teixeira Porto, de 27 anos, que atua no HC.
Ainda em junho, Doria disse que a vacina estaria disponível pelo Sistema Único de Saúde em junho de 2021. Em setembro, ele afirmou que as primeiras doses já poderiam ser aplicadas em 15 de dezembro para os profissionais da área da saúde. Pouco tempo depois, em outubro, o governador voltou a falar que a aplicação ficará para 2021. Afinal, após a análise dos testes, ainda falta o aval da agência reguladora. As doses, no entanto, começam a chegar nesta quinta-feira, 19, e vão ficar armazenadas em São Paulo até a liberação da Anvisa. Em 30 de dezembro, 6 milhões de doses da CoronaVac já vão estar em território nacional.
Eficácia e segurança
O resultado dos estudos relacionados à fase 3 de testes da CoronaVac no Brasil só devem sair após os 13 mil voluntários serem imunizados e pelo menos 61 pessoas terem contato com o vírus. Não dá para prever uma data, mas acredita-se que a meta está próxima de ser alcançada ainda neste ano. Os testes da vacina são duplo-cego, ou seja, metade dos voluntários recebeu a CoronaVac e a outra metade recebeu placebo. Nem os médicos e nem os voluntários sabem qual dose foi aplicada. Quando os 61 infectados forem alcançados, os estudos vão ser abertos e vai ser possível analisar quantos dos que testaram positivo receberam a vacina. E é essa a porcentagem que vai indicar o nível de eficácia do imunizante — acima de 50% ela já se mostra muito eficiente, de acordo com cientistas. A potencial vacina da Pfizer/BioNTech, a da americana Moderna e a russa Sputnik indicaram mais de 90% de eficácia em estudos preliminares. Se com 61 casos de Covid-19 não for possível demonstrar a eficácia, é preciso esperar 151 positivos.
Entretanto, alguns estudos do imunizante feitos na China já trazem resultados animadores. Um deles, publicado em agosto pela Sinovac, indica que, nos testes da fase 2, mais de 90% dos 600 voluntários que receberam as vacinas tiveram anticorpos capazes de neutralizar o coronavírus. Esse mesmo estudo mostrou também que a imunização aconteceria entre duas e quatro semanas após a aplicação da segunda dose. No início de setembro, o Governo de SP anunciou que, também na China, agora em análise da fase 3 dos testes, os estudos mostraram que pessoas com mais de 60 anos que receberam mais de uma dose da CoronaVac tiveram resposta imunológica de 98%. Em outra coletiva, no fim de setembro, também foram apresentados mais resultados — dessa vez, mostrando que 94,7% dos mais de 50 mil voluntários da CoronaVac na China não apresentaram nenhum sintoma adversos em relação à vacina. De acordo com o governador João Doria, apenas 5,3% apresentaram efeitos — e foram de baixa gravidade, como dor no local da aplicação da injeção. Quanto aos estudos no Brasil, a única coisa que se sabe é que apenas 18% dos quase 9 mil voluntários tiveram dores no local da aplicação — menos de 5% apresentaram edema, inchaço ou coceira na pele.
Quanto às reações sistêmicas, a mais frequente foi a dor de cabeça, que pode ou não estar relacionada à aplicação. Menos de 5% tiveram náusea, vômito, febre, diarreia, mialgia, calafrio, perda de apetite, tosse, artralgia, coceira ou feridas na pele. Isso fez da CoronaVac a potencial vacina em desenvolvimento mais segura no que diz respeito aos efeitos colaterais. No dia 2 de outubro, o governo estadual registrou os primeiros documentos para análise da Anvisa com o objetivo de agilizar o processo o máximo possível dentro das normas científicas e da agência reguladora. No dia 17 de novembro, os resultados dos estudos clínicos da vacina CoronaVac, foram publicados pela revista científica Lancet Infectious Diseases e mostraram que o imunizante teve a capacidade de produzir resposta imune no organismo em 97% dos casos após 28 dias da sua aplicação. Os dados dizem respeito às fases 1 e 2 reuniram 744 voluntários na China, com idades entre 18 e 59 anos.
Investimentos
O Instituto Butantan recebe nesta quinta-feira, 19, as primeiras 120 mil doses da CoronaVac prontas para aplicação. Elas fazem parte de um lote de 6 milhões que foi aprovado pela Anvisa no dia 23 de outubro e devem chegar no Brasil até o fim de dezembro. Fora isso, a agência reguladora também autorizou, no dia 28 de outubro, a importação da vacina adsorvida Covid-19 — a matéria-prima para outras 40 milhões de doses. Até fevereiro, está prevista a chegada de mais 14 milhões. Até maio, a previsão é que o Brasil já tenha 100 milhões de doses da CoronaVac para imunização dos brasileiros. Vale lembrar que, se forem necessárias duas doses para cada pessoa, serão 50 milhões de pessoas imunizadas — pouco mais de população do Estado de São Paulo, estimada pelo IBGE, que é de 46,4 milhões. Ou seja, se o governo federal não fechar um contrato a nível nacional para inserir a vacina no Programa Nacional de Imunização (PNI), é possível que as doses adquiridas até o momento não sejam capaz de abranger o Brasil todo.
Fora isso, o Butantan também iniciou, no dia 2 de novembro, as obras na fábrica que vai produzir a vacina contra a Covid-19. Ela está prevista para ficar pronta em setembro de 2021, tem cerca de 10 mil m² de espaço e vai ter capacidade para produzir 100 milhões de doses por ano. De acordo com o presidente do instituto, Dimas Covas, o modelo de fábrica que vai ser implantado é avançado e isso só foi permitido por causa da parceria público-privada que contribuiu para as obras. De fato, o investimento foi grande. Já são pelo menos R$ 130 milhões de recursos privados envolvidos no projeto, fruto da doação de 24 empresas de diversos setores, nacionais e internacionais, e sem nenhuma contrapartida. A meta é de R$ 160 milhões.
Vacina obrigatória
Durante o mês de outubro, o debate sobre a vacina ficou marcado por acusações e defesas sobre uma possível politização da ciência. De um lado, o governador João Doria manifestou o interesse de tornar a imunização contra a Covid-19 obrigatória. Do outro, o presidente Jair Bolsonaro bateu o pé, chamou Doria de “médico do Brasil” e chegou até a desmentir o ministro da Saúde, Eduardo Pazuello, após uma manifestação de interesse de compra da CoronaVac. Além disso, por causa do laboratório Sinovac ser da China, algumas frentes do governo colocam em xeque a confiabilidade do imunizante.
No dia 16 de outubro, Doria afirmou que a vacina contra o coronavírus vai ser obrigatória no Estado após a liberação da Anvisa. De acordo com ele, somente pessoas que apresentarem atestado médico serão liberadas da obrigatoriedade de receber o imunizante. “Em São Paulo, a vacinação será obrigatória, exceto para quem tenha orientação médica e atestado de que não pode tomar a vacina. E adotaremos medidas legais se houver contrariedade nesse sentido”, disse. Depois, no dia 20, após uma reunião virtual com governadores, Pazuello sinalizou a compra de 46 milhões de doses da vacina do Butantan até dezembro de 2020 — incluindo-a no Programa Nacional de Imunização (PNI).
No dia seguinte, Bolsonaro declarou, em uma rede social, que a compra não seria feita. Minutos depois, o secretário-executivo do Ministério da Saúde, Élcio Franco, afirmou que “não há intenção de compra de vacinas chinesas” e que, no depender da pasta, a vacina contra Covid-19 não será obrigatória. Em nota, a Secretaria da Saúde de São Paulo e o Instituto Butantan afirmaram receber “com surpresa e indignação” a declaração do governo federal. Na contramão de Bolsonaro, o vice-presidente Hamilton Mourão lamentou a politização e afirmou que “qualquer vacina que seja comprovadamente testada e certificada pela Anvisa estará à disposição para ser adquirida”. Mourão fez questão de lembrar que a Coronavac será produzida pelo Instituto Butantan, que tem sede em São Paulo, e apenas os insumos virão da China.
No início de novembro, governadores de pelo menos 11 estados se encontraram com o presidente da Câmara dos Deputados, Rodrigo Maia, e o do Senado Federal, Davi Alcolumbre, para pedir a intermediação com o governo federal para garantir uma vacina no PNI — a primeira aprovada pela Anvisa, sem politização. No último dia 9, o presidente afirmou que o governo federal vai comprar e disponibilizar qualquer vacina contra a Covid-19 que passar pelo aval do Ministério da Saúde e for certificada pela Anvisa. Quanto à obrigatoriedade da vacina, a Lei 13.979, sancionada pelo próprio Bolsonaro em fevereiro deste ano, estabelece um artigo que determina a realização compulsória de vacina e outras medidas profiláticas em razão do coronavírus. O mesmo artigo prevê também a realização de isolamento e quarentena — não apoiados pelo presidente desde o início da pandemia.
Interrupção dos testes
Na noite do dia 9 de novembro, a Anvisa interrompeu os estudos clínicos da CoronaVac alegando um “evento adverso grave”. Por questões éticas, as autoridades de saúde não podiam informar características sobre o evento — sexo da pessoa, nome ou até mesmo o que aconteceu — o que voltou a levantar dúvidas a respeito da segurança da vacina. Porém, dias mais tarde foi confirmado que a pausa foi motiva pelo óbito de um voluntário em decorrência de um suicídio. Na época, o Instituto Butantan alegou não entender o motivo da paralisação porque entregou todos os documentos necessários à agência reguladora — que negou o fato. Entretanto, o diretor do instituto, Dimas Covas, declarou acreditar que a confusão foi uma falha de comunicação e não uma interferência política no órgão técnico. Após a causa mortis ser confirmada, além da não relação com o imunizante, os testes foram retomados no dia 11 de novembro.


Comentários
Conteúdo para assinantes. Assine JP Premium.