Anvisa recebe pedido do Instituto Butantan para uso emergencial da CoronaVac
Agência tem 10 dias para analisar a proposta; imunizante apresentou eficácia de 78% em casos leves, chegando a 100% em casos mais graves da Covid-19
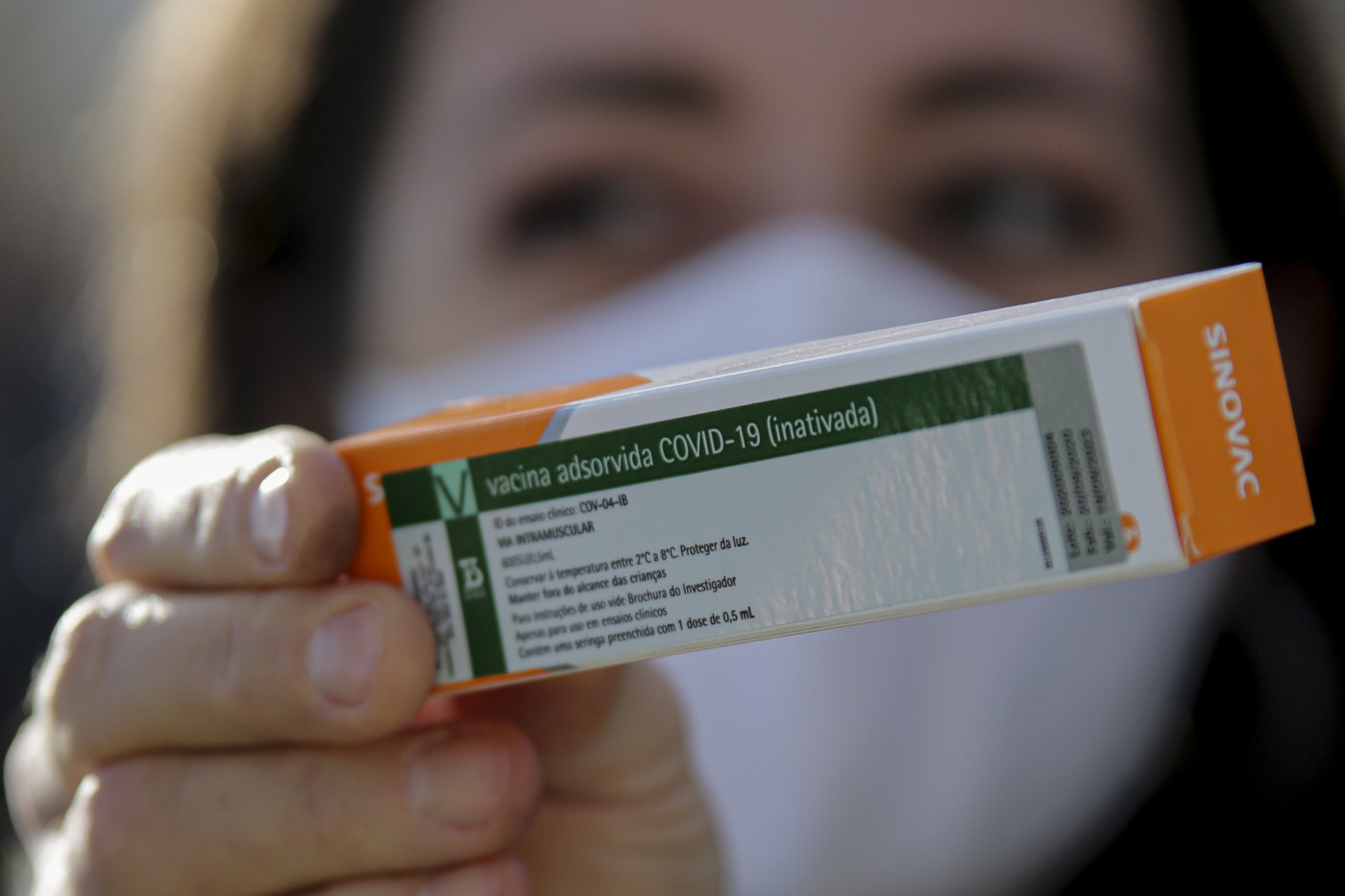
O Instituto Butantan enviou às 9h34 desta sexta-feira, 8, o pedido oficial para o uso emergencial da vacina CoronaVac à Agência Nacional de Vigilância Sanitária (Anvisa). Na quinta-feira, 7, o governo do estado de São Paulo divulgou que o imunizante, que é desenvolvido pela empresa chinesa Sinovac e pelo Instituto Butantan, tem eficácia comprovada de 78% nos estudos clínicos realizados no Brasil. De acordo com as informações divulgadas, a taxa vale para os casos leves e atendimentos ambulatoriais — o imunizante preveniu 100% de casos moderados, graves e internações. Segundo a Anvisa, a triagem dos documentos presentes na solicitação já foi iniciada, assim como a proposta de uso emergencial que o laboratório pretende fazer.
Ainda na quinta-feira, o Butantan e a Anvisa tiveram uma reunião de pré-submissão do imunizante na qual a instituição apresentou os dados consolidados à agência. “O procedimento acordado é a realização de uma reunião que chamamos de pré-submissão de pedido de uso emergencial e posteriormente o laboratório envia o pedido oficial”, explicou a Anvisa. As entidades se reuniram mais uma vez na tarde de quinta para tratar sobre o pedido oficial, que foi enviado pelo Butantan nesta sexta. “As primeiras 24h serão utilizadas para fazer uma triagem do processo e checar se os documentos necessários estão disponíveis. Se houver informação importante faltando, a Anvisa pode solicitar as informações adicionais ao laboratório”, esclarece. A agência tem 10 dias para analisar os documentos, mas ressalta que o prazo não considera o eventual tempo que o processo possa ficar pendente de informações, que devem ser apresentadas pelo laboratório. Para fazer sua avaliação, a Anvisa também irá considerar as informações já analisadas por meio da Submissão Contínua. O pedido definitivo ainda não vai ser realizado porque precisa ser feito pela Sinovac. A previsão de início da vacinação no dia 25 de janeiro em São Paulo está mantida.



Comentários
Conteúdo para assinantes. Assine JP Premium.