Pfizer encaminha dados à Anvisa e inicia processo para aprovação de vacina
Resultados da fase 3, a última antes da liberação, foram entregues para agência reguladora nesta quarta-feira, 25; farmacêutica também pleiteia registro nos EUA e Europa
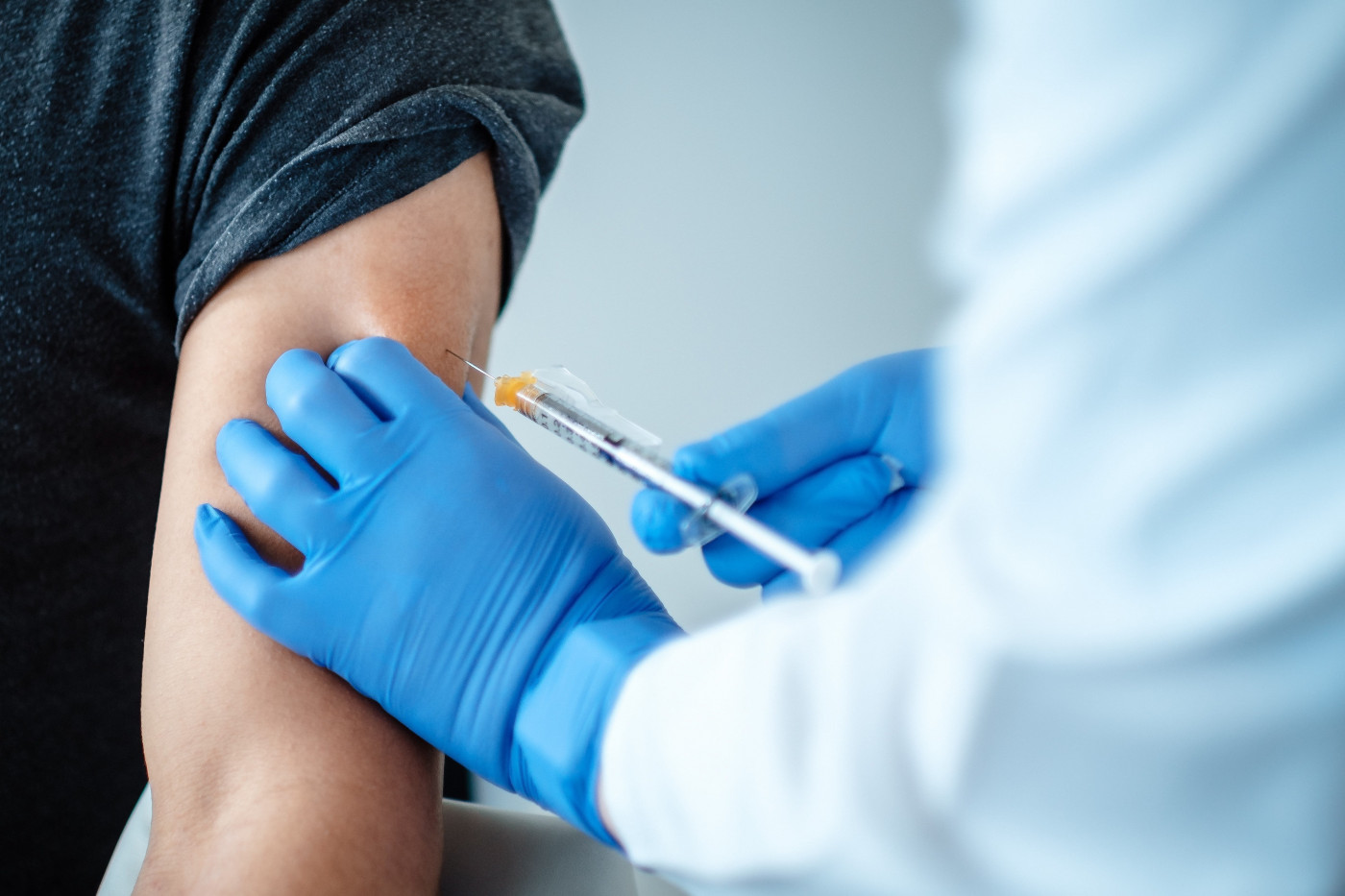
A farmacêutica Pfizer informou nesta quarta-feira, 25, que encaminhou à Agência Nacional de Vigilância (Anvisa) resultados dos testes da sua vacina contra o novo coronavírus. Os dados encaminhados para avaliação se referem a fase 3 de testes — a última antes da aprovação — do imunizante BNT162b2, desenvolvido em parceria com o laboratório alemão BioNTech. Segundo a farmacêutica, o pedido de submissão inclui os resultados que apontam eficácia de 95%, sete dias após a administração da segunda dose, conforme anunciado na semana passada. O pedido de submissão continua ainda não é um pedido formal de registro do imunizante, mas acelera os trâmites para aprovação assim que os dados são encaminhados pela farmacêutica, desde que eles demonstrem qualidade, segurança e eficácia conforme os requerimentos técnicos e regulatórios da autoridade nacional. “Esta submissão também tem como base dados de segurança de um subconjunto aleatório de aproximadamente 8.000 participantes de 18 anos de idade ou mais, e de dados de segurança de aproximadamente 38 mil participantes do estudo, que foram acompanhados por dois meses em média após a segunda dose da vacina experimental”, divulgou a farmacêutica.
A submissão contínua é um novo procedimento implementado pela Anvisa e específico para as vacinas contra a Covid-19, com o objetivo de dar maior agilidade à análise regulatória dos dossiês de registro dessas vacinas. Além da agência brasileira, a Pfizer já protocolou pedidos junto autoridades nos Estados Unidos, União Europeia e Reino Unido. “Esse é um importante passo para que o imunizante esteja disponível no Brasil. A Pfizer disponibilizará todos os dados necessários para avaliação e estará em total colaboração com a Anvisa para que esse processo transcorra da melhor maneira e o mais rapidamente possível”, diz Márjori Dulcine, diretora médica da Pfizer Brasil.
O estudo clínico da fase 3 foi iniciado em 27 de julho e admitiu 43.661 participantes até o momento, sendo que 41.135 deles receberam uma segunda dose da vacina experimental até o dia 13 de novembro de 2020. Ao todo, foram 150 locais de pesquisa nos EUA, Alemanha, Turquia, África do Sul, Brasil e Argentina. No Brasil, participaram 2.900 voluntários e os trabalhos foram conduzidos pelo Centro Paulista de Investigação Clínica (Cepic) e pelas Obras Assistenciais Irmã Dulce, em Salvador. “A Pfizer e a BioNTech planejam apresentar os dados de eficácia e segurança do estudo para revisão por revistas científicas, assim que a análise dos dados for concluída”, informou a empresa.
Técnicos do Ministério da Saúde já estão em contato com representantes da farmacêutica norte-americana para a compra do imunizante. Segundo a pasta, o objetivo “é conhecer os resultados dos testes em andamento e as condições de compra, logística e armazenamento oferecidas pelo laboratório”. A aquisição dos imunizantes “deve ocorrer à medida em que os ensaios clínicos apontarem a total eficácia e segurança dos insumos e o registro na Anvisa for realizado”, afirmou o ministério. Na última semana, após reunião com membros do governo, o presidente da Pfizer no Brasil, Carlos Murillo, falou sobre as perspectivas de a vacina ser aplicada aqui no país. A previsão do governo é que, entre janeiro e março, a primeira remessa de vacinas esteja disponível e contemple inicialmente os grupos de risco. Um dos desafios logísticos são as baixíssimas temperaturas necessárias para conservar o imunizante.
Na sexta-feira da semana passada, 20, a Pfizer solicitou nos EUA uma autorização de uso emergencial da vacina contra a Covid-19 que está sendo desenvolvida por elas conjuntamente. O pedido foi feito à Agência de Medicamentos e Alimentos dos Estados Unidos (FDA, na sigla em inglês). Esse é o primeiro imunizante a buscar essa permissão da agência reguladora norte-americana. Em comunicado, a Pfizer afirmou que, se o pedido for aprovado, a sua vacina pode estar disponível até o fim de dezembro para os grupos de risco, incluindo trabalhadores da área de saúde, idosos e pessoas com problemas graves de saúde.

Comentários
Conteúdo para assinantes. Assine JP Premium.