Anvisa autoriza Butantan a importar 6 milhões de doses da CoronaVac
Apesar da liberação, vacina não poderá ser aplicada imediatamente no país; ‘utilização do produto ficará condicionada à obtenção de seu registro sanitário’, diz decisão divulgada no site da agência
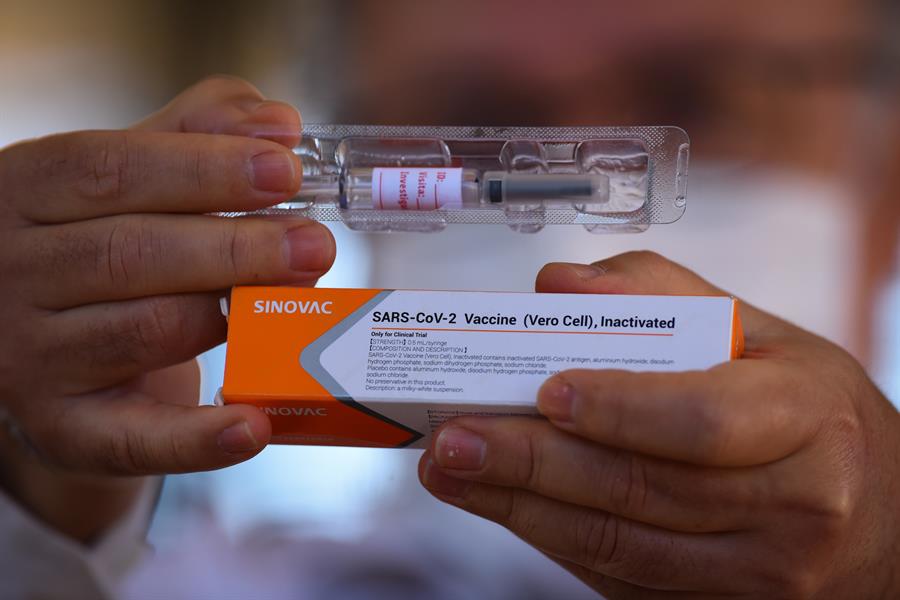
A Agência Nacional de Vigilância Sanitária (Anvisa) liberou, nesta sexta-feira, 23, a importação de seis milhões de doses da CoronaVac, vacina chinesa que será produzida pelo Instituto Butantan, em São Paulo. “A Diretoria Colegiada decidiu, por unanimidade, autorizar a importação, em caráter excepcional, de 6.000.000 (seis milhões) de doses da Vacina Adsorvida Covid-19 (inativa) – produto acabado, fabricada por Sinovac Life Sciences Co. Ltd. (China), conforme solicitação do Instituto Buntantan, nos termos do voto do relator”, diz o texto, disponível no site da agência. A decisão foi tomada um dia depois de o diretor do Instituto Butantan, Dimas Covas, questionar o prazo para a liberação da importação de insumos.
Em seu voto, o presidente da Anvisa, Antonio Barra Torres ressalta que isso não significa que a vacina poderá ser aplicada imediatamente no Brasil. “A utilização do produto ficará condicionada à obtenção de seu registro sanitário junto à Anvisa. Por oportuno, necessário esclarecer que a carga ficará sob a custódia do Instituto Butantan, seu fiel depositário, que deverá mantê-la em suas instalações, e em perfeitas condições de acondicionamento, até que possa ser utilizada ou destruída”. Em outro trecho, Barra Torres, relator do processo, ressalta que é de responsabilidade do Instituto Butantan “garantir a eficácia, segurança e qualidade do produto, inclusive o monitoramento do seu uso e o exercício da farmacovigilância”.
Diante da declaração de Dimas Covas, a Anvisa divulgou uma nota, nesta sexta, para negar que o atraso seja proposital. No comunicado, a agência afirma que no mesmo processo para a obtenção dos insumos estava o pedido para a importação excepcional “de vacina na forma de seringa preenchida e na forma de um produto intermediário, isto é, o produto não envasado/bulke”. “Assim sendo, não há nenhum tipo de retardo/atraso/morosidade por parte da Anvisa. A análise foi feita e as discrepâncias foram encaminhadas para o laboratório a fim de serem solucionadas”, diz outro trecho da nota. A explicação ocorre em meio ao imbróglio do Ministério da Saúde e o Estado de São Paulo para a compra de 46 milhões de doses do imunizante. Após confirmar o compromisso de aquisição da Coronavac na última terça, a pasta voltou atrás depois de fortes críticas do presidente Jair Bolsonaro.



Comentários
Conteúdo para assinantes. Assine JP Premium.