CoronaVac produz anticorpos em 97% dos casos, revela estudo científico
Primeiros resultados de testes foram publicados pela revista Lancet; vacina chinesa apresenta capacidade de produzir resposta imune no organismo 28 dias após a aplicação
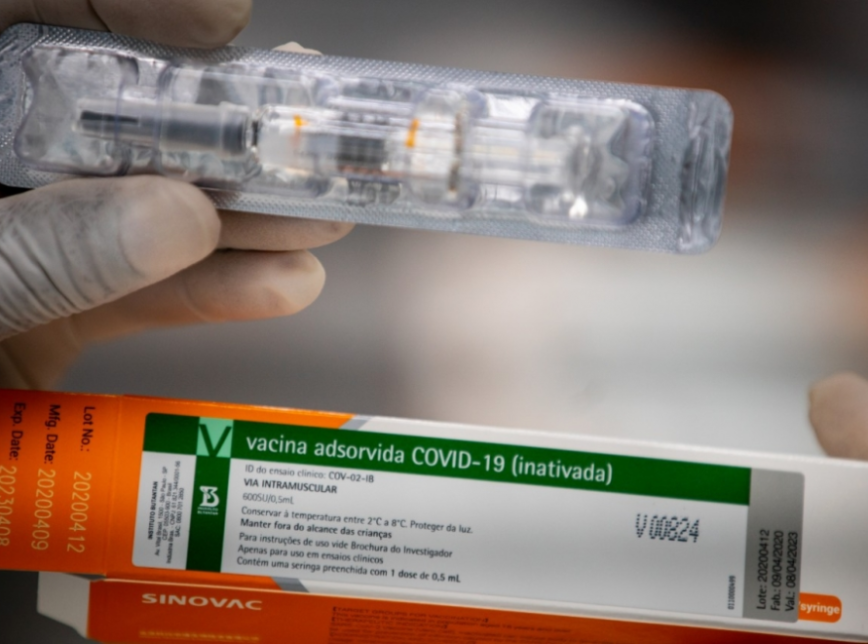
Resultados dos estudos clínicos da vacina CoronaVac, desenvolvida pela empresa chinesa Sinovac em parceria com o Instituto Butantan, e publicados na noite desta terça-feira, 17, pela revista científica Lancet Infectious Diseases mostram que a vacina teve a capacidade de produzir resposta imune no organismo 28 dias após sua aplicação em 97% dos casos. De acordo com o Butantan, os resultados, que contam com a revisão de diversos cientistas, “são mais um passo importante para o desenvolvimento da vacina, que está em fase 3 de testes em diversas regiões do Brasil desde julho deste ano”.
As fases 1 e 2 reuniram 744 voluntários na China, com idades entre 18 e 59 anos. Os dados mostram que as reações foram leves e nenhum efeito adverso sério relacionado à vacina foi identificado. A reação mais comum foi dor no local da aplicação. A taxa de soroconversão entre os voluntários que receberam o imunizante, ou seja, produção de anticorpos, ficou acima dos 90%. O artigo científico apresenta dados que já eram de conhecimento do Instituto Butantan e da Agência Nacional de Vigilância Sanitária (Anvisa), uma vez que a partir deles foi possível aprovar o uso emergencial em mais de 50 mil pessoas na China e a realização do estudo de fase 3 no Brasil.
Suspensão dos testes
No último dia 9, a Anvisa suspendeu os testes com a vacina, em razão da ocorrência de um “evento adverso grave”. O caso foi registrado no boletim de ocorrência como “suicídio consumado”. Horas depois, na manhã da quarta-feira, 11, a Anvisa anunciou que havia autorizado a retomada do processo. O órgão afirmou que, ao avaliar os dados apresentados pelo Butantan após a suspensão dos estudos, entendia que tinha “subsídios suficientes para permitir a retomada da vacinação e segue acompanhando a investigação do desfecho do caso para que seja definida a possível relação de causalidade entre o EAG inesperado e a vacina”. A Anvisa também reiterou, em nota, que “uma suspensão não significa necessariamente que o produto sob investigação não tenha qualidade, segurança ou eficácia”, pois são “eventos comuns em pesquisa clínica e todos os estudos destinados a registro de medicamentos que estão autorizados no país são avaliados previamente pela ANVISA com o objetivo de preservar a segurança para os voluntários do estudo”.
Em fase final de estudos no Brasil, a Coronavac é considerada uma das vacinas mais promissoras no mundo, de acordo com a Organização Mundial da Saúde (OMS), e vem sendo testada em sete estados brasileiros, além do Distrito Federal. Coordenados pelo Instituto Butantan, os testes envolvem 13 mil profissionais de saúde em 16 centros de pesquisa de São Paulo, Rio de Janeiro, Minas Gerais, Rio Grande do Sul, Paraná, Mato Grosso, Mato Grosso do Sul e Distrito Federal. Até o momento, mais de 10 mil pessoas já receberam ao menos uma das duas doses da vacina ou placebo. Para determinar a eficácia da CoronaVac, é preciso que 151 participantes que receberam a substância sejam contaminados pelo coronavírus. A partir desta amostragem, haverá a comparação com o total dos que receberam a vacina e, eventualmente, também tenham diagnóstico positivo do novo coronavírus. Se o imunizante atingir os índices necessários de eficácia e segurança, deverá ser submetido à avaliação da Anvisa para registro e posterior uso em campanhas de imunização contra a doença.



Comentários
Conteúdo para assinantes. Assine JP Premium.