Covid-19: Quais são as vacinas que já foram aprovadas e as que estão em fase final de testes
Estão sendo aplicados no Brasil três imunizantes, a Coronavac, a de Oxford e a da Pfizer + BioNTech, que se encontram na terceira fase de estudos; a vacina da Johnson & Johnson deve entrar nesta etapa de testes no mês de outubro
O desenvolvimento de uma vacina normalmente leva anos de pesquisas e testes até estar disponível para a aplicação em humanos. No entanto, a corrida pela imunização contra a Covid-19 está mobilizando cientistas em todo o mundo, a ponto de alguns mais otimistas falarem em uma imunização em larga escala ainda neste ano. Atualmente, são 27 vacinas em testes na fase 1, 14 na fase 2, oito na fase 3, e três já aprovadas para uso limitado. Uma delas é a chinesa CanSino, liberada para uso militar; a outra é a vacina russa, anunciada pelo presidente Vladimir Putin no dia 11 de agosto; além da chinesa Sinopharm, cuja aprovação foi dada pelo governo dos Estados Unidos mesmo antes da comprovação de que seria eficaz. O infectologista da BP, Beneficência Portuguesa de São Paulo, Heber Azevedo, afirma que alguns fabricantes dizem que “é possível que exista uma vacina para casos emergenciais a partir de outubro deste ano”. No entanto, ele ressalta que isso é “uma expectativa, pois nada garante que os resultados da fase 3 serão satisfatórios”.
As primeiras pesquisas começaram ainda em janeiro, quando as contaminações pelo novo coronavírus explodiram na China. Nesta época, cientistas decifraram o genoma do SARS-Cov-2. Já os primeiros testes em humanos foram feitos em março, com resultados pouco conclusivos. Atualmente, três vacinas na fase 3 estão sendo testadas no Brasil, a CoronaVac, a de Oxford e a da Pfizer + BioNTech, e uma deve começar ainda no mês de outubro, a da Johnson & Johnson. O governo do Paraná também mantém contato com representantes da Rússia para viabilizar a produção do imunizante no Brasil. O acordo entre as partes foi assinado em 12 de agosto, o que foi considerado uma sinalização para uma futura testagem, produção e distribuição da vacina no estado. O governador de São Paulo, João Doria, disse que a CoronaVac — que se mostrou eficiente até o momento — deve ser aplicada na população brasileira já na segunda quinzena de dezembro, de acordo com os critérios adotados pela Secretaria Estadual da Saúde, dentro dos protocolos do Ministério da Saúde.

Imunizações aprovadas para uso limitado:
1) Vacina da CanSino
A empresa chinesa CanSino Biologics desenvolveu uma vacina baseada em um adenovírus chamado Ad5, em parceria com o Instituto de Biologia da Academia de Ciências Médicas Militares do país. Em maio, eles publicaram resultados promissores de um teste de segurança da fase 1 e, em julho, relataram que seus testes da fase 2 demonstraram que a vacina produziu uma forte resposta imunológica. Em 25 de junho, os militares do país aprovaram a vacina por um ano por ser uma “droga especialmente necessária”. Em 9 de agosto, o ministério da saúde da Arábia Saudita anunciou que a empresa realizaria um teste de fase 3 no país. No dia 17 de agosto, o Escritório de Propriedade Intelectual da China, Sipo, na sigla em inglês, aprovou a primeira patente para a vacina da CanSino.
2) Vacina russa Sputnik V
No dia 11 de agosto, o presidente da Rússia, Vladimir Putin, anunciou a primeira vacina registrada contra a Covid-19. Desde então, o governo do Paraná mantém contato com representantes do país para viabilizar a produção do imunizante no Brasil. O acordo entre as partes foi assinado em 12 de agosto, o que foi considerado uma sinalização para uma futura testagem, produção e distribuição da vacina no estado. O Ministério da Saúde da Rússia anunciou no dia 8 de setembro que o primeiro lote da Sputnik V, desenvolvida pelo Instituto Gamaleya de Epidemiologia e Microbiologia, passou nos testes de qualidade e foi liberado para a comunidade civil. O ministério russo, por outro lado, disse que a cura do novo coronavírus estará à disposição da sociedade em breve, mas não especificou as datas. No dia 4, um estudo conduzido pela publicação científica “The Lancet ” já havia afirmado que a vacina russa é segura, não possui efeitos colaterais severos e é capaz de produzir anticorpos contra a infecção causada pelo vírus. Desta forma, a liberação da Sputnik V acontecerá concomitantemente com os testes clínicos da fase 3, que serão feitos em 40 mil voluntários, sendo que 30 mil receberão o imunizante e 10 mil receberão uma substância placebo. A Rússia espera registrar, ainda, uma segunda vacina em potencial contra a Covid-19 até o dia 15 de outubro, disse a agência de notícias TASS, citando o órgão regulador russo de segurança do consumidor Rospotrebnadzor, no dia 22 de setembro. O possível novo composto foi desenvolvido pelo Instituto Vector, da Sibéria, que concluiu o estágio inicial de testes em humanos na semana passada.
3) Vacina da Sinopharm
Depois de descobrir que uma vacina inativada contra o vírus era segura e provocou uma resposta imune, a empresa estatal chinesa Sinopharm começou a fazer, em julho, testes da fase 3 dela nos Emirados Árabes e, no mês seguinte, no Peru e no Marrocos. A empresa também está testando uma segunda vacina de vírus inativado, desenvolvida pelo Instituto de Produtos Biológicos de Pequim. Os testes estão na fase 3, porém em 14 de setembro, os Estados Unidos deram aprovação de emergência para utilizar as vacinas em profissionais de saúde, mesmo antes que a Sinopharm compartilhasse dados indicando que era segura e eficaz.
Imunizações que estão na fase 3 de testes:
Atualmente, oito vacinas estão nesta fase de estudos. É somente depois desta prova, realizada em milhares de participantes, que ela pode ou não ser licenciada e liberada para a comercialização. Os voluntários também precisam ser acompanhados por meses, para demonstrar que há poucas infecções entre os que receberam a vacina em comparação com aquelas que receberam um placebo. Só assim as imunizações poderão ser aprovadas por órgãos reguladores — como a Anvisa aqui no Brasil.
1) Vacina de Oxford
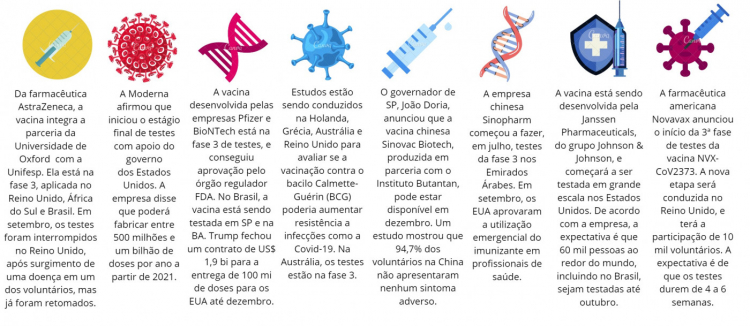
Da farmacêutica AstraZeneca, a vacina integra a parceria da Universidade de Oxford (Reino Unido) com a Unifesp (Universidade Federal de São Paulo). Ela está na fase 3 de testagem, aplicada em voluntários no Reino Unido, África do Sul e Brasil, sendo 5 mil voluntários em São Paulo, Rio de Janeiro e Salvador. Em 20 de julho, cientistas de Oxford afirmaram que a vacina é segura e induz resposta imunológica. As informações foram divulgadas pela revista médica “The Lancet”. No entanto, em setembro, os testes foram interrompidos no Reino Unido, após o surgimento de uma doença em um dos voluntários. Um documento publicado pela Universidade de Oxford disse que a doença pode não estar associada à vacina, e os testes já foram retomados no país. No Brasil, não chegaram a ser interrompidos, e o diretor-presidente da Anvisa, Antonio Barra Torres, disse acreditar que a paralisação não atrapalharia o cronograma de prazos previsto. “Foi uma parada rápida, o sistema funcionou prontamente, a análise do caso foi conclusiva e com rapidez. Acredito que o planejamento, em termos de prazo, não deva sofrer atraso significativo”, disse. Já nos EUA, a farmacêutica AstraZeneca seguia, até o dia 24 de setembro, esperando a aprovação da agência reguladora de remédios para retomar os estudos.
2) Vacina da Moderna
O laboratório Moderna afirmou, no final de julho, que iniciou o estágio final de testes em uma candidata a vacina para a Covid-19, com apoio do governo dos Estados Unidos. Esta é a primeira pesquisa a ser implementada no programa anticoronavírus Operation Warp Speed, do governo de Donald Trump. Os testes da fase 3 serão feitos em 30 mil adultos sem registro da doença respiratória, em 89 locais nos EUA. Em 11 de agosto, o governo concedeu à empresa um adicional de US$ 1,5 bilhão em troca de 100 milhões de doses, caso a vacina se mostrasse segura e eficaz. Em comunicado, a Moderna afirmou que poderá fabricar entre 500 milhões e 1 bilhão de doses por ano a partir de 2021, após chegar a um acordo de colaboração com a empresa suíça Lonza, que garantiu a distribuição das doses necessárias para a conclusão do estudo. Em 17 de setembro, a Moderna afirmou que planeja esperar até que um número significativo de voluntários adoeça com a Covid-19 para ver quantos foram vacinados. Pode demorar até o final de 2020 ou início de 2021 para atingir os números necessários.
3) Pfizer e BioNTech
A vacina desenvolvida por pesquisadores de laboratórios dos Estados Unidos e da Alemanha das empresas Pfizer e BioNTech está na fase 3 de testes, e conseguiu aprovação em via rápida pelo órgão regulador dos Estados Unidos, a FDA. No dia 5 de agosto, a imunização começou a ser testada em voluntários brasileiros, que têm entre 18 e 85 anos. A Anvisa autorizou, em 18 de setembro, que o número de voluntários brasileiros que estão participando dos estudos seja dobrado. Com a permissão, o número passou de mil para 2 mil. A vacina BNT162 está sendo testada em São Paulo e na Bahia. Um artigo publicado no dia 20 de julho como prévia (pré-print) apontou que a substância é segura e capaz de induzir resposta imunológica. De acordo com as farmacêuticas, foram verificadas respostas imunes “fortes”, e em velocidade anterior ao prazo estimado, das chamadas células T, consideradas fundamentais para protegerem um organismo do novo coronavírus. No dia 12 de setembro, as empresas anunciaram que queriam expandir os testes nos EUA para 43 mil voluntários. No mesmo mês, o governo Trump fechou um contrato de US$ 1,9 bilhão para a entrega de 100 milhões de doses até dezembro, além da opção de adquirir mais 500 milhões. O Japão fechou um acordo para 120 milhões de doses, e a União Europeia conseguiu comprar 200 milhões de unidades. Em setembro, o presidente-executivo da Pfizer disse que, em outubro, teria as respostas sobre a real eficácia da vacina. Se aprovada, a companhia disse que espera fabricar mais de 1,3 bilhão de doses em todo o mundo até o final de 2021.
4) CoronaVac
O governo do Estado de São Paulo anunciou, no dia 23 de setembro, resultados de um estudo chinês que mostrou que 94,7% dos mais de 50 mil voluntários da CoronaVac não apresentaram nenhum sintoma adverso em relação à vacina. No Brasil, ela está sendo testada pelo Instituto Butantan em parceria com o laboratório Sinovac. Segundo o governador João Doria, o resultado dos estudos clínicos mostram apenas 5,3% de efeitos de baixa gravidade — como é o caso de dor no braço no local da aplicação da injeção. “Esses resultados comprovam um excelente perfil de segurança”, afirmou. “Desde o dia 21 de julho, no Brasil, não tivemos registro de reações adversas graves. Além de segura, ela é altamente eficiente”, completou Doria. Na China, a CoronaVac apresentou eficiência de 98% na imunização. O governador anunciou também que o primeiro lote de vacina, com 5 milhões de doses, chega ao Instituto Butantan em outubro, mas ainda é preciso aguardar o fim da terceira e última fase de testagem — além dos resultados e a aprovação da Anvisa. Mas, de acordo com ele, ao que tudo indica, na segunda quinzena de dezembro, a CoronaVac já deve ser aplicada na população, de acordo com os critérios adotados pela Secretaria Estadual da Saúde, dentro dos protocolos do Ministério da Saúde. Segundo a Reuters, em julho, o governo chinês deu à vacina Sinovac uma aprovação de emergência para uso limitado. Enquanto isso, a empresa se prepara para fabricar a vacina, e chegou a um acordo para fornecer à Indonésia pelo menos 40 milhões de doses até março de 2021.
5) Vacina da Sinopharm
Depois de descobrir que uma vacina inativada contra o vírus era segura e provocou uma resposta imune, a empresa estatal chinesa Sinopharm começou a fazer, em julho, testes da fase 3 nos Emirados Árabes e, no mês seguinte, no Peru e no Marrocos. O ministro da Saúde de Abu Dhabi foi o primeiro voluntário a ser imunizado e 15 mil pessoas devem participar no total. Em julho, o presidente da Sinopharm disse que a vacina poderia estar disponível para a população até o fim deste ano. A Sinopharm também está testando uma segunda vacina de vírus inativado, desenvolvida pelo Instituto de Produtos Biológicos de Pequim. Os testes estão na fase 3 na Argentina e também nos Emirados Árabes Unidos, onde 5 mil pessoas recebem a versão do Instituto Wuhan, enquanto outras 5 mil a do Instituto de Pequim. Em 14 de setembro, os Estados Unidos deram aprovação de emergência para utilizar as vacinas em profissionais de saúde, mesmo antes que a Sinopharm compartilhasse dados indicando que era segura e eficaz.
6) Vacina contra a tuberculose
Estudos estão sendo conduzidos na Holanda (Nijmegen’s Radboud University and Utrecht University), Grécia (University of Athens), Austrália (University of Melbourne) e Reino Unido (University of Exeter) para avaliar se a vacinação contra o bacilo Calmette-Guérin (BCG) poderia aumentar a resistência a infecções em geral, como a Covid-19, em profissionais de saúde e idosos. Na Austrália, os testes estão na fase 3. Um estudo conduzido pela Universidade de Michigan, nos Estados Unidos, na revista Science Advances, indicou que os países onde a vacina contra as formas graves da tuberculose é obrigatória apresentaram taxas mais baixas de infecção e morte pelo novo coronavírus durante o primeiro mês da pandemia.
7) Vacina da Johnson&Johnson
A vacina contra o novo coronavírus que está sendo desenvolvida pela Janssen Pharmaceuticals, do grupo Johnson & Johnson, começou a ser testada em grande escala nos Estados Unidos. Na Europa, um total de 550 voluntários saudáveis de três países, Espanha, Bélgica e Alemanha, participarão dos testes da fase 3. De acordo com a empresa, a expectativa é que 60 mil pessoas ao redor do mundo, incluindo o Brasil, sejam testadas até outubro. A vacina da Janssen, chamada Ad26.COV2.S, utiliza uma tecnologia baseada em um adenovírus recombinante não-replicativo para gerar uma resposta imunológica contra uma das proteínas do coronavírus.
8) Vacina da Novavax
A farmacêutica americana Novavax anunciou, em 24 de setembro, o início da terceira fase de testes de uma vacina contra a Covid-19 desenvolvida por ela, a NVX-CoV2373. A nova etapa será conduzida no Reino Unido, em parceria com o governo local, e terá participação de 10 mil voluntários. A expectativa é de que os testes durem de quatro a seis semanas. Segundo comunicado, a empresa afirmou que o imunizante não precisa ser congelado e pode ser armazenado em ambientes com temperatura entre 2ºC e 8ºC. Em agosto, a farmacêutica comunicou que a vacina mostrou resposta positiva. Cerca de 80% dos voluntários — recrutados na Austrália — tiveram efeitos colaterais, especialmente dores, e 60% tiveram dores de cabeça e musculares. Oito deles sofreram efeitos “severos”, mas se recuperaram em poucos dias e não precisaram ser hospitalizados. A Novavax, uma pequena empresa farmacêutica do estado de Maryland, recebeu US$ 1,6 bilhão para trabalhar no desenvolvimento de vacinas da chamada “Operação Warp Speed” do governo dos EUA.
Confira o gráfico:

Comentários
Conteúdo para assinantes. Assine JP Premium.